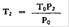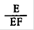Anlage 1
ANHANG | |||
BESTIMMUNG DES ERUKASÄUREGEHALTS IN SPEISEÖLEN UND -FETTEN SOWIE IN LEBENSMITTELN MIT ÖL- UND FETTZUSÄTZEN | |||
I. EINLEITUNG | |||
1. | VORBEREITUNG DER PROBE | ||
1.1. | Allgemeines | ||
Die Menge der zu analysierenden Laborprobe beträgt in der Regel 50 g, sofern nicht eine größere Menge erforderlich ist. | |||
1.2. | Vorbereitung der Probe | ||
Die Probe ist vor der Analyse zu homogenisieren. | |||
1.3. | Lagerung | ||
Die so vorbereitete Probe muß ständig in einem gut verschlossenem Behälter gelagert werden. | |||
2. | REAGENZIEN | ||
2.1. | Wasser | ||
2.1.1. | Ist für Lösungen. Verdünnungen und Waschungen Wasser erforderlich, so handelt es sich stets um destilliertes Wasser oder entmineralisiertes Wasser von mindestens gleichwertiger Reinheit. | ||
2.1.2. | Wird bei einer „Lösung“ oder einer „Verdünnung“ kein Hinweis auf ein Reagenz gegeben, so handelt es sich stets um eine wäßrige Lösung. | ||
2.2. | Chemikalien | ||
Sofern keine gegenteiligen Angaben vorliegen, müssen alle Chemikalien analysenreine Qualität besitzen. | |||
3. | GERÄTE | ||
3.1. | Geräteliste | ||
Die Geräteliste enthält Ausrüstungen für besondere Zwecke mit besonderen Spezifikationen. | |||
3.2. | Analysenwaagen | ||
Unter Analysenwaage ist eine Waage mit einer Meßgenauigkeit von mindestens 0,1 mg zu verstehen. | |||
4. | DARSTELLUNG DER ERGEBNISSE | ||
4.1. | Ergebnisse | ||
Das im Analysenbericht genannte Ergebnis stellt den Mittelwert von mindestens zwei Bestimmungen mit ausreichender Wiederholbarkeit dar. | |||
4.2. | Berechnung des Prozentsatzes | ||
Außer bei besonderen Vorschriften werden die Ergebnisse in Prozent (m/m) der Gesamtfettsäuren der Probe, die das Laboratorium erhielt, angegeben. | |||
4.3. | Anzahl der Dezimalstellen | ||
Das Ergebnis ist mit nicht mehr Stellen nach dem Komma anzugeben, als die Genauigkeit des Analyseverfahrens zuläßt. | |||
II. BESTIMMUNG DER ERUKASÄURE | |||
1. | GEGENSTAND UND ANWENDUNGSBEREICH DER METHODE | ||
Mit dieser Methode kann der Erukasäuregehalt
bestimmt werden. | |||
2. | DEFINITION | ||
Erukasäuregehalt: Erukasäure, bestimmt nach der beschriebenen Methode. | |||
3. | PRINZIP | ||
Die Methylester der Fettsäuren werden auf Silbernitrat enthaltenden Dünnschichtplatten bei tiefer Temperatur getrennt. Die getrennten Ester werden gaschromatographisch quantitativ bestimmt. | |||
4. | REAGENZIEN | ||
4.1. | Frisch destillierter Diäthyläther, frei von Peroxid | ||
4.2. | n-Hexan | ||
4.3. | Kieselgel G für Dünnschichtchromatographie | ||
4.4. | Kieselgel für Säulenchromatographie | ||
4.5. | Silbernitratlösung 200 g/l. 24 g Silbernitrat werden in Wasser gelöst und mit Wasser auf 120 ml aufgefüllt. | ||
4.6. | Lösung des Erukasäuremethylesters, 5 mg/ml. 50 mg Erukasäuremethylester werden in einigen ml n-Hexan gelöst und mit n-Hexan auf 10 ml verdünnt. | ||
4.7. | Lösung des Tetracosansäuremethylesters als innerer Standard, 0,25 mg/ml. 25 mg Tetracosansäuremethylester werden in einigen ml n-Hexan (wie in 4.6) gelöst und auf 100 ml aufgefüllt. | ||
4.8. | Fließmittel. Toluol: n-Hexan 90 : 10 (v/v) | ||
4.9. | 2,7 Dichlorfluoresceinlösung, 0,5 g/1. 50 mg 2,7-Dichlorfluorescein werden unter Erhitzen und Umrühren in 100 ml 50%igem wasserhaltigem Methanol gelöst. | ||
5. | GERÄTE | ||
5.1. | Geräte für die Dünnschichtchromatographie, insbesondere einschließlich: | ||
5.1.1. | Tiefkühlschrank, der die Trennkammer einschließlich Inhalt auf Temperaturen von minus 20 ºC bis minus 25 ºC halten kann | ||
5.1.2. | Glasplatten, 200 mm x 200 mm | ||
5.1.3. | Ultraviolettlampe | ||
5.1.4. | Glassäule 200 mm lang, Innendurchmesser 10 mm, versehen mit Glaswolle oder Glasfilterboden. Alternativ kleine Glasfiltertrichter | ||
5.1.5. | Gerät zum Auftragen von Lösungen in Form eines schmalen Streifens oder einer Linie | ||
5.2. | Gaschromatograph mit elektronischem Integrator wie in Anhang VI Abschnitt III der Verordnung (EWG) Nr. 72/77 beschrieben. | ||
6. | ARBEITSVORSCHRIFT | ||
6.1. | Herstellung von Fettsäuremethylestern | ||
Von etwa 400 mg Öl oder Fett der Analysenprobe wird nach der in Anhang VI Abschnitt II Absatz 3 der Verordnung (EWG) Nr. 72/77 beschriebenen Methode eine Lösung von etwa 20 bis 50 mg/ml der Fettsäuremethylester in Hexan hergestellt. | |||
6.2. | Dünnschichtchromatographie | ||
6.2.1. | Herstellung der Platten | ||
60 g Kieselgel (4.3) und 120 ml Silbernitratlösung (4.5) werden in einen 500-ml-Rundkolben gegeben und eine Minute zur Herstellung einer homogenen Suspension geschüttelt. Die Suspension wird in üblicher Weise in einer Schichtdicke von etwa 0,5 mm auf die Platten aufgebracht. Die Menge reicht zur Beschichtung von fünf Platten von je 200 x 200 mm. Die Platten werden an der Luft vorgetrocknet (am besten etwa 30 Minuten im Dunkeln); danach werden sie etwa 2 Stunden und 30 Minuten bei 100 ºC im Trockenschrank getrocknet und aktiviert. Nach der Aktivierung sollten die Platten sobald wie möglich verwendet werden, andernfalls sind sie sorgfältig im Dunkeln zu lagern und vor ihrer Verwendung zu aktivieren. (Anmerkung: Eine einstündige Aktivierung bei 110 ºC kann ausreichen, sofern die Platten dabei nicht dunkel werden). Um bei der Entwicklung Randeffekte zu vermeiden, sollten auf jeder Platte im Abstand von 10 mm von den Seiten und vom oberen Rand Striche durch die Schichten gezogen werden, bevor die Platten verwendet werten. | |||
6.2.2. | Auftragen der Methylester | ||
Mit dem Auftraggerät (5.1.5) werden 50 myl der aus der Probe hergestellten Methylesterlösung (6.1) in einem schmalen etwa 50 mm langen Streifen und im Abstand von wenigstens 40 mm von der Seite und 10 myl vom unteren Rand der Platte aufgetragen. In gleicher Weise werden 100 myl einer Mischung, die zu gleichen Teilen aus Methylesterlösung (6.1) und der Lösung des Erukasäuremethylesters (4.6) besteht, aufgetragen. Wegen der Empfindlichkeit der Schichten ist beim Auftragen der Lösungen besonders vorsichtig vorzugehen. Nach dem Auftragen der Methylester kann der untere Rand der Platte in Diäthyläther getaucht werden, bis der Äther etwa 5 mm über die Startlinie aufgestiegen ist. Dadurch werden die Methylester auf einen schmalen Streifen konzentriert. | |||
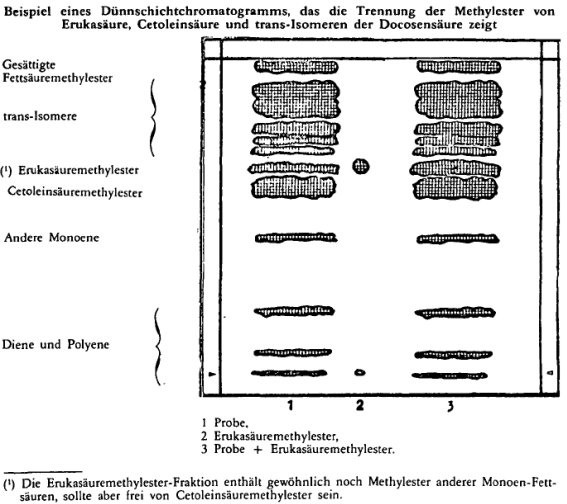
Anmerkung: Eventuell können noch 50 myl der Erukasäuremethylesterlösung (4.6) auf die Platte aufgetragen werden, um nach der Entwicklung die Identifizierung der Erukasäuremethylester enthaltenden Zone zu erleichtern (vgl. Abbildung). | |||
6.2.3. | Entwicklung der Platten | ||
Es wird eine ausreichende Menge Fließmittel (4.8) bis zu einer Höhe von 5 mm in die Trennkammer gegeben und diese mit Deckel in einen Tiefkühlschrank (5.1.1) gestellt, dessen Temperatur bei minus 25 ºC oder so nahe wie möglich bei dieser Temperatur liegt. (In einigen Fällen kann es zweckmäßig sein, die Trennkammer auszukleiden.) Nach zwei Stunden wird die Platte vorsichtig in die Trennkammer gestellt und man läßt das Fließmittel bis etwa zur Hälfte oder zwei Dritteln der Plattenhöhe aufsteigen. Nach dem Herausnehmen der Platte wird das Fließmittel im schwachen Stickstoffstrom von der Platte entfernt. Dann wird die Platte erneut in die Trennkammer gestellt und man läßt das Fließmittel bis zum oberen Rand der Platte aufsteigen. Anschließend wird die Platte wieder herausgenommen, wie oben beschrieben im Stickstoffstrom getrocknet und darin mit der 2,7-Dichlorfluoresceinlösung (4.9) besprüht. | |||
Bei der Betrachtung im UV-Licht kann die Erukasäuremethylester enthaltende Zone der Probe durch Vergleich mit der intensiveren Zone der Probe, der Erukasäuremethylester zugefügt wurde, lokalisiert werden (vgl. Abbildung). | |||
6.2.4. | Trennung der Methylesterfraktionen | ||
Die Erukasäuremethylester enthaltende Zone der Probe wird quantitativ von der Platte abgekratzt und in ein 50-ml-Becherglas gegeben. Das Kieselgel ober- und unterhalb der Erukasäuremethylesterzone, das alle anderen Fettsäuremethylesterfraktionen enthält, wird ebenfalls quantitativ von der Platte geschabt und in ein anderes 50-ml-Becherglas gegeben. In jedes Becherglas werden 1,0 ml der Tetracosansäuremethylester enthaltenden Standardlösung (4.7) und 10 ml Diäthyläther gegeben (4.1). Es wird umgerührt und der Inhalt der beiden Bechergläser jeweils in eine mit etwa 1 g Kieselgel (4.4) gefüllte Säule bzw. Glasfiltertrichter (5.1.4) gegeben. | |||
Die Ester werden mit drei oder vier mal 10 ml Diäthyläther extrahiert. Die Eluate werden in kleinen Glaskolben gesammelt. Sie werden im schwachen Stickstoffstrom vorsichtig auf kleine Volumina eingedampft und dann in Spitzgläschen überführt. Das restliche Lösungsmittel wird dann so im Stickstoffstrom verdampft, daß sich die Methylester in der Spitze des Gläschens konzentrieren. Anschließend werden die Methylester in etwa 25 bis 50 myl Hexan (4.2) gelöst. | |||
6.3. | Gaschromatographie | ||
6.3.1. | Nach der in Anhang VI Abschnitt III der Verordnung (EWG) Nr. 72/7 beschriebenen Methode werden 1 bis 2 myl der Methylesterlösungen eingespritzt, die i) aus der Erukasäuremethylester enthaltenden Fraktion und ii) aus den Fraktionen, die die restlichen Fettsäuremethylester enthalten, gewonnen wurden. | ||
6.3.2. | Mit Hilfe eines elektronischen Integrators erhält man folgende Peakflächen:
| ||
7. | DARSTELLUNG DER ERGEBNISSE | ||
7.1. | Berechnungsmethode und Formeln | ||
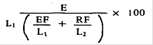
7.1.1. | Der Erukasäuregehalt der Probe, berechnet als Prozent Methylester der Gesamtfettsäuremethylester, ergibt sich aus der Formel | ||
hierbei bedeuten: | |||
E, EF, RE, L1, und L2 die Peakflächen entsprechend 6.3.2, die erforderlichenfalls durch Eichfaktoren korrigiert werden. Der mit vorstehender Formel ermittelte Gehalt an Erukasäuremethylester entspricht dem Gehalt an Erukasäure, bezogen auf die Gesamtfettsäuren. | |||
7.1.2. | Werden die Peakflächen in Prozenten angegeben, so können für EF und RF nachstehende Werte eingesetzt werden | ||
EF = 100 –L1 RF = 100 –L2. | |||
7.1.3. | Die Formel unter 7.1.1 setzt voraus, daß der Tetracosansäuregehalt der Probe vernachlässigt werden kann. Wenn jedoch signifikante Mengen an Tetracosansäure vorhanden sind, so muß der Wert für Tetracosansäure (L2), der aus dem Chromatogramm der restlichen Fraktionen ermittelt wurde, vermindert werden auf: | ||
L2 –T2 | |||
Dabei ist: | |||
und | |||
T2 = | Peakfläche des Tetracosansäuremethylesters, der aus der Probe stammt, und der einen Teil der Peakfläche des inneren Standards in der Fraktion der restlichen Fettsäuremethylester ausmacht; | ||
P2 = | Peakfläche des Palmitinsäuremethylesters in dem Chromatogramm der restlichen Fraktion; | ||
T0 = | Peakfläche des Tetracosansäuremethylesters in demChromatogramm der Gesamtfettsäuremethylester, die bei der in Artikel 2 der Richtlinie beschriebenen Analyse bestimmt wurden; | ||
P0 = | Peakfläche des Palmitinsäuremethylesters in demChromatogramm der Gesamtfettsäuremethylester, die bei der in Artikel 2 der Richtlinie beschriebenen Analyse bestimmt wurden. | ||
7.1.4. | Ableitung der Formel | ||
Der in der Erukasäuremethylester-Fraktion enthaltene prozentuale Anteil an Fettsäuren, bezogen auf die Gesamtfettsäuren der Probe, ergibt sich aus | |||
Der Anteil an Erukasäure in der Erukasäuremethylester enthaltenden Fraktion ist | |||
Folglich ist der Erukasäuregehalt der Probe, ausgedrückt in Prozent der Gesamtfettsäuren: | |||
7.1.5. | Wiederholbarkeit | ||
Der Unterschied zwischen den Ergebnissen zweier unter denselben Bedingungen, durch denselben Analytiker, an derselben Probe gleichzeitig oder in rascher Folge vorgenommenen Bestimmungen darf nicht mehr als 10 relativ, bezogen auf den ermittelten Wert, oder 0,5 g pro 100 g der Probe betragen, wobei der jeweils größere Wert gilt. | |||
ABBILDUNG
Schlagworte
Speisefett, Ölzusatz
Zuletzt aktualisiert am
25.04.2017
Gesetzesnummer
10010781
Dokumentnummer
NOR12136928
alte Dokumentnummer
N8199421727L
Zusatzdokumente: image001, image002, image003, image004, image005, image006
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)